15.E23 : Mesure du faraday
On réaliser l'expérience dont le protocole est donné ci-dessous.
- - Peser les masses \(m_+\) et \(m_-\) de deux plaques de cuivre avec une balance de précision.
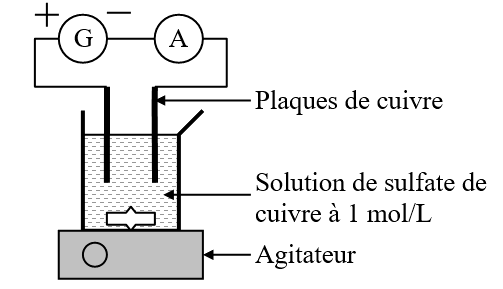
- - On réalise le dispositif du schéma ci-contre.
- - Régler le générateur pour qu'il délivre un courant d’intensité constante \(I = \pu{1,0 A}\).
- - Laisser fonctionner le montage pendant exactement \(\pu{10 min}\).
- - Rincer les électrodes. Les sécher correctement. Les peser.
Les résultats expérimentaux sont les suivants :
- - Plaque du côté de la borne + : \(m_+^{avant} = \pu{19,18 g}\) ; \(m_+^{apres} = \pu{18.99 g}\).
- - Plaque du côté de la borne – : \(m_–^{avant} = \pu{28,32 g}\) ; \(m_–^{apres} = \pu{28.51 g}\).
1 Déterminer l’anode (oxydation) et la cathode (réduction) en tenant compte des bornes du générateur et écrire les équations des demi-réactions qui se produisent à l’anode et à la cathode. En déduire la réaction globale de l'électrolyse.
2 A partir de la variation de masse de la cathode, déterminer la quantité de matière d’électron ayant circulé dans le circuit.
3 A partir de la valeur de l’intensité du courant et du temps de fonctionnement du dispositif, déterminer la quantité d’électricité Q ayant circulé dans le circuit.
4 En déduire la valeur du faraday.
5 Indiquer si la valeur trouvée est conforme à la valeur officielle.
Données :
\(M(\ce{Cu}) = \pu{63,5 g*mol-1}\)
\(F = \pu{96 500 C*mol-1}\)
