15.E21 : Électrolyse du bromure de cuivre
Données sur les espèces chimiques
Le cuivre solide \(\ce{Cu(s)}\) est de couleur rougeâtre.
Les ions cuivre II en solution aqueuse \(\ce{Cu^2+(aq)}\) ont une couleur bleue.
Le dibrome en solution aqueuse \(\ce{Br2(aq)}\) a une couleur brune.
L'équation de la réaction chimique \(\ce{Cu(s) + Br2(aq) ⇆ Cu^2+(aq) + 2 Br–(aq)}\) a une constante d'équilibre \(K = \pu{1,2E25}\).
A Expérience n° 1
On plonge un petit morceau de cuivre dans une solution de dibrome.
A.1 Donner l'équation de la réaction qui se produit.
A.2 Donner l'expression du quotient de réaction.
A.3 Calculer sa valeur dans l'état initial.
A.4 En déduire le sens d'évolution spontané de la réaction.
A.5 Lister les observations que l'on devrait faire lors de l'expérience.
B Expérience n° 2
On réalise l'électrolyse d'une solution aqueuse de bromure de cuivre II avec des électrodes inattaquables en graphite. Le schéma du dispositif et les observations sont données dans le schéma ci-dessous.
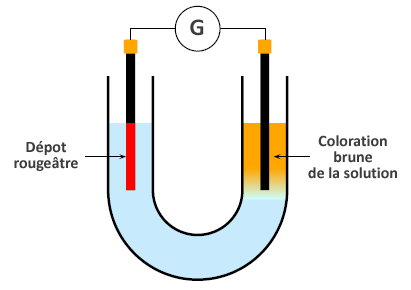
B.1 Lister les espèces chimiques initialement présentes en solution.
B.2 A partir des observations, indiquer :
- - la demi-équation qui se produit au niveau de l'électrode de droite ;
- - la demi-équation qui se produit au niveau de l'électrode de gauche ;
- - le sens de déplacements des électrons dans les fils ;
- - le sens du courant et les bornes + et – du générateur.
B.3 En déduire l'équation de la réaction associée à l'électrolyse.
