15.E13 : Une pile cuivre-fer
La pile cuivre-fer est réalisée à partir d’une demi-pile de cuivre constituée d’une solution aqueuse de concentration \(c_1 = \pu{0,20 mol*L–1}\) en ions cuivre et d’une demi-pile de fer constituée d’une solution aqueuse de concentration \(c_2 = \pu{0,30 mol*L–1}\) en ions fer (II).
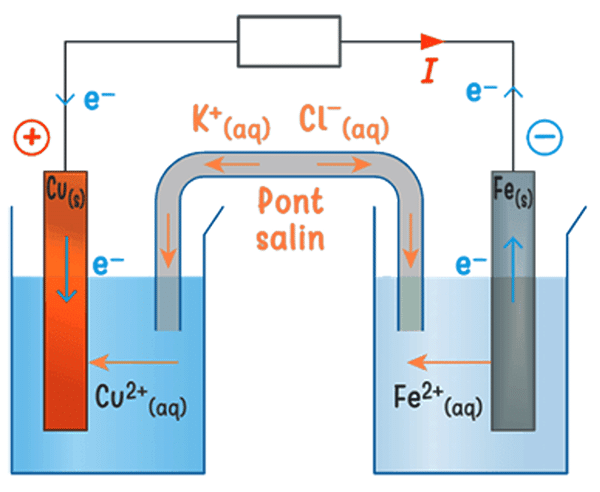
Lorsque la pile débite un courant dans un circuit, il se produit la réaction de constante d’équilibre \(K(T) = \pu{1,9E37}\) : \(\ce{Cu^2+(aq) + Fe(s) ⇄ Cu(s) + Fe^2+(aq)}\)
Données : Le Faraday, c’est-à-dire la valeur absolue de la charge molaire d’électron, est \(F = \pu{9,65E4 C·mol–1}\).
1 Déterminer le quotient de réaction Qr,i dans l’état initial. En déduire le sens d’évolution de la transformation.
2 Écrire les demi-équations des réactions d’oxydoréduction se produisant aux électrodes.
3 Le mouvement des électrons sur le schéma est-il cohérent avec vos réponses aux deux questions précédentes ?
4 Justifier le sens du courant indiqué sur le circuit.
5 Indiquer l'évolution de la concentration en ion fer dans la demi-pile de fer.
6 Justifier le mouvement des ions venant du pont salin.
7 Indiquer ce qu'il se passe si l'on retire le pont salin.
8 La solution de cuivre (II) a un volume \(V_1 = \pu{50 mL}\) et le fer est en excès. Calculer la capacité \(Q\) de la pile.
