15.E11 : Pile et concentration
On réalise une pile avec les couples \(\ce{Ag+(aq) / Ag(s)}\) et \(\ce{Fe3+(aq) / Fe^2+(aq)}\) comme schématisé ci-dessous.
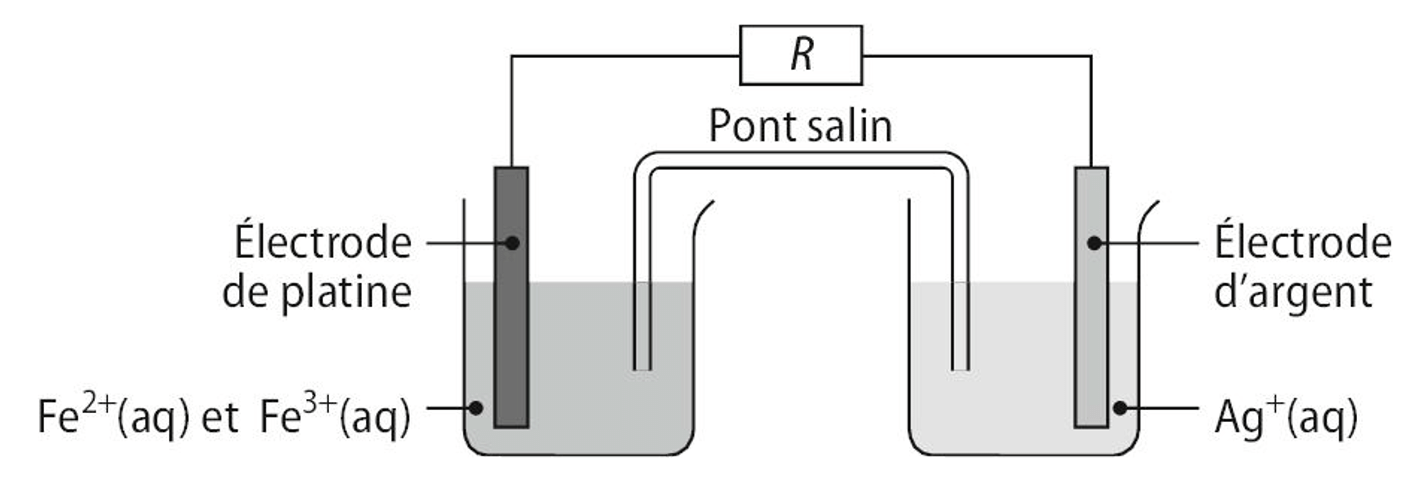
Les concentrations en quantité de matière initiales des ions dans les demi-piles sont : \([\ce{Ag+}]_i = [\ce{Fe^2+}]_i = [\ce{Fe^3+}]_i = \pu{1,0E–1 mol*L–1}\).
La constante d’équilibre associée à la réaction dont l’équation est \(\ce{Ag+(aq) + Fe^2+(aq) <--> Ag(s) + Fe^3+(aq)}\) vaut \(K(T) = \pu{3,2}\) à \(\pu{25 °C}\).
1 Calculer le quotient de réaction à l’état initial.
2 En déduire le sens d’évolution spontané de la transformation quand la pile fonctionne.
3 En justifiant avec les demi-équations électroniques, indiquer le sens de circulation des électrons à l’extérieur de la pile et préciser la polarité de la pile.
4 On réalise une deuxième pile en modifiant les concentrations initiales en quantité de matière : \([\ce{Ag+}]_i = [\ce{Fe^2+}]_i = \pu{1,0E–1 mol*L–1}\) ; \([\ce{Fe^3+}]i = \pu{1,0E–2 mol*L–1}\).
Justifier si la polarité de la pile reste la même.
