Chap15 : Piles et électrolyseurs
I - Les piles électrochimiques
1 - Principe d'une pile électrochimique
a) Comment obtenir du courant à partir d'une réaction chimique ?
Considérons un réducteur et un oxydant qui peuvent réagir spontanément en échangeant des électrons.
Si on éloigne le réducteur et l’oxydant, on peut parvenir à faire circuler les électrons dans un circuit électrique : c'est le principe de la pile.
b) Constitution d’une pile
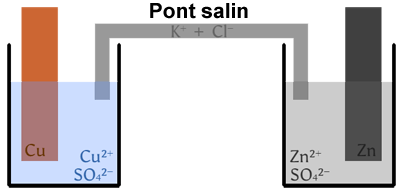
Une pile est constituée de deux demi-piles reliées par un pont salin :
- • Une demi-pile est constituée de l’oxydant et/ou du réducteur d’un couple, ainsi que d’une électrode.
- • Le pont salin est une solution (ou un gel) qui contient des ions et assure la continuité électrique entre les deux demi-piles.
Remarque : si le réducteur est un métal solide, celui-ci peut servir d’électrode.
Exemple d'une pile Daniell :
- - demi-pile avec le couple \(\ce{Cu^2+(aq)/Cu(s)}\) à gauche ;
- - demi-pile avec le couple \(\ce{Zn^2+(aq)/Zn(s)}\) à droite.
c) Fonctionnement d’une pile
15.A1 - Piles électrochimiques
Exemple d'une pile Daniell :

d - Caractéristiques électriques de la pile
Lorsque la pile ne débite pas de courant, la tension entre les électrodes est appelée tension à vide. Elle se mesure à l’aide d’un voltmètre.
La borne + est l’électrode de la demi-pile où les électrons arrivent, c'est-à-dire où l’oxydant est consommé, ce qui correspond à la réduction.
La borne – est l’électrode de la demi-pile d'où les électrons partent, c'est-à-dire où le réducteur est consommé, ce qui correspond à l'oxydation.
2 - Capacité électrique d’une pile
a - Définition
La capacité électrique d’une pile est la charge électrique maximale que la pile est susceptible de faire circuler dans un circuit extérieur (de l’état initial à l’état final). Elle se note \(Q\) et s'exprime en coulomb (\(\pu{C}\)).
b - Calcul
15.A2 - Capacité électrique d'une pile
On peut montrer que : \(Q = n(e^–)×F\)
- \(Q\) (en \(\pu{C}\)) est la capacité électrique de la pile ;
- \(n(e^–)\) (en \(\pu{mol}\)) est la quantité de matière d'électrons échangés entre l'état initial et l'état final ;
- \(F\) est la constante de Faraday (\(F = N_A×e = \pu{96500 C*mol-1}\)).
La grandeur \(n(e^–)\) se détermine à partir d'un tableau d'avancement.
Si la constante d’équilibre de la réaction écrite dans le sens de fonctionnement de la pile est supérieure à \(10^4\), on peut considérer que l’état final est un état maximal, ce qui simplifie la démarche.
II - Électrolyseurs
1 - Généralités
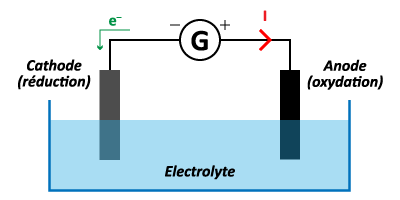
Un électrolyseur est un dispositif composé de deux tiges conductrices appelées électrodes, plongeant dans une solution appelée électrolyte.
Un générateur force la circulation des électrons afin de permettre une réaction d'oxydoréduction.
L'électrode où se produit l'oxydation est appelée l'anode, elle est reliée à la borne + du générateur.
L'électrode où se produit la réduction est appelée la cathode, elle est reliée à la borne – du générateur.
2 - Calcul de la variation de la quantité de matière
D'une part, par définition : \(I = \dfrac{Q}{Δt}\)
- \(I\) (en \(\pu{A}\)) est l'intensité du courant électrique ;
- \(Q\) (en \(\pu{C}\)) est la quantité d'électricité échangée ;
- \(Δt\) (en \(\pu{s}\)) est la durée de l'expérience.
D'autre part, d'après le tableau d'avancement de la réaction : \(Q = n(e^–)×F\)
- \(Q\) (en \(\pu{C}\)) est la quantité d'électricité échangée ;
- \(n(e^–)\) (en \(\pu{mol}\)) est la quantité de matière d'électron échangée entre les électrodes ;
- \(F\) est la constante de Faraday (\(F = \pu{96500 C*mol-1}\))
III - Stockage et conversions d'énergie chimique
La pile convertit l'énergie chimique en énergie électrique. L'électrolyseur convertit l'énergie électrique en énergie chimique.
Un accumulateur est un système qui peut se comporter comme une pile ou un électrolyseur.
Dans la nature, les organismes chlorophylliens assurent la conversion de l'énergie lumineuse en énergie chimique (photosynthèse). L'énergie chimique peut ensuite être restituée.