15.TP1 : Piles et électrolyseurs
Compétences travaillées :
• Réaliser une pile, déterminer sa tension à vide et la polarité des électrodes, identifier la transformation mise en jeu, illustrer le rôle du pont salin.
• Identifier les produits formés lors du passage forcé d’un courant dans un électrolyseur. Relier la durée, l’intensité du courant et les quantités de matière de produits formés.
Matériel :
• Au bureau
- 2 L de solution de chlorure de sodium concentrée
- 1,5 L de solution de sulfate de cuivre II à 1 mol/L
- 1 L de solution de sulfate de cuivre à 0,1 mol/L
- 1 L de solution de sulfate de fer à 0,1 mol/L
- 0,2 L de solution pour pont salin (par exemple K⁺ + Cl⁻)
- Allumettes
- Buchettes (une par groupe)
- Papiers buvards pour pont salin (un par groupe)
- Morceaux de papier de verre (un par groupe)
- Fils de connexion
• Pour une manip faite par le prof
- 1 cuve à électrolyse
- 0,5 L de solution d’hydroxyde de sodium
- 4 tubes à essais
- 2 bouchons
• Sur les paillasses des élèves
- Générateur de tension continue (avec affichage de I et V)
- Multimètre
- 4 béchers de 150 mL
- 1 coupelle en porcelaine
- Pile cuivre/fer :
- 1 lame de cuivre
- 1 lame de fer
- 1 boite de résistance variable
- Électrolyse solution de chlorure de sodium :
- tube en U + support
- 1 bouchon avec électrode de graphite
- 1 bouchon avec électrode de graphite et petit tube effilé.
- 1 tube à essais
- petit flacon avec de l’iodure de potassium
- petit flacon avec de la phénolphtaléïne
- Dispositif pour électrolyse du cuivre :
- dispositif avec 1 plaque de cuivre et un fil de cuivre très fin
- boîtier avec lampe (6 V, 200 mA)
I - Les piles
1) - Réalisation de la pile
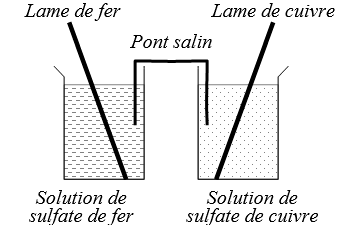
🖑 Réaliser la pile correspondant au dispositif ci-contre :
• Introduire une lame de fer décapée dans un bécher de \(\pu{150 mL}\) contenant environ \(\pu{75 mL}\) de solution de sulfate de fer.
• Introduire une lame de cuivre décapée dans un bécher de \(\ce{150 mL}\) contenant environ \(\pu{75 mL}\) de solution de sulfate de cuivre.
• Préparer le pont salin (dans une coupelle, imbiber une bande de papier de solution de K⁺ + Cl⁻) et relier les deux béchers.
1) Donner les équations des demi-réactions de chaque demi-pile.
2 - Pile à vide et en fonctionnement
a - Tension à vide
🖑 A l'aide du voltmètre, déterminer les bornes + et – de la pile ainsi que la tension entre ses bornes.
2) En déduire le sens de circulation des électrons.
3) Donner l'équation de la réaction chimique correspondant au fonctionnement de la pile.
b - Intensité du courant lors du fonctionnement de la pile
🖑 Brancher une résistance de \(\pu{33 Ω}\) et un ampèremètre en série aux bornes de la pile.
🠶 Relever la valeur de l’intensité du courant.
4) En déduire le sens de circulation du courant et des électrons. Ce résultat est-il cohérent avec celui du a ?
II - Les électrolyseurs
1 - Électrolyse d'une solution aqueuse de chlorure de sodium
Données sur les espèces chimiques :
Une solution de chlorure de sodium \(\ce{Na+(aq) + Cl–(aq)}\) a un pH neutre.
La solution d’iodure de potassium \(\ce{K+ + I–}\) prend une coloration brun foncé en présence de dichlore \(\ce{Cl2 (g)}\).
Le dioxygène \(\ce{O2 (g)}\) ravive la flamme d’une bûchette présentant un point incandescent.
Le dihydrogène \(\ce{H2 (g)}\) produit une petite détonation en présence d’air et d’une flamme.
La phénolphtaléine est incolore pour \(pH < \pu{8,2}\) et rose fuchsia pour \(pH> \pu{10}\).
Couples oxydant/réducteur :
\(\ce{H2O(l)/H2(g)}\) ; \(\ce{O2(g)/H2O(l)}\) ; \(\ce{H+(aq)/H2(g)}\) ; \(\ce{Na+(aq)/Na(s)}\) ; \(\ce{Cl2(g)/Cl–(aq)}\).
a - Manipulations
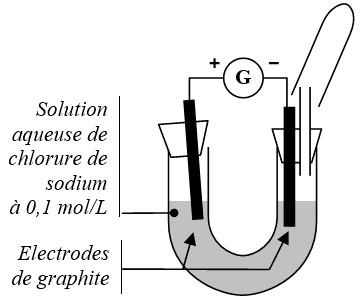
🖑 Réaliser le montage de la figure ci-contre avec un générateur de tension continue de valeur réglable.
🖑 Augmenter lentement la tension délivrée par le générateur jusqu’à observer un dégagement gazeux. Dépasser légèrement cette valeur (environ \(\pu{9 V}\)).
🖑 Après quelques minutes de fonctionnement :
- - verser quelques gouttes d’iodure de potassium du côté de la borne +.
- - réaliser les tests pour identifier le gaz recueilli dans le tube à essais.
- - verser quelques gouttes de phénolphtaléïne du côté de la borne –.
🠶 Noter les résultats de vos tests.
b - Interprétations
1) Écrire les demi-équations électroniques correspondant à chacun des couples.
2) Faire la liste des espèces chimiques présentes avant le démarrage de l'électrolyse.
En déduire le sens possible de chaque demi-réaction.
3) A partir des résultats des tests, indiquer le sens possible de chaque demi-réaction.
4) Indiquer le sens de circulation des électrons du fait de la présence du générateur.
5) Bilan : A partir de tous les résultats précédents, déterminer :
- - la demi-équation de la réaction qui se produit du côté de la borne +.
- - la demi-équation de la réaction qui se produit du côté de la borne –.
- - l’équation de l’électrolyse (en précisant l’état de chaque espèce chimique).
2 - Électrolyse d'une solution aqueuse de sulfate de cuivre avec électrode de cuivre
a - Manipulation
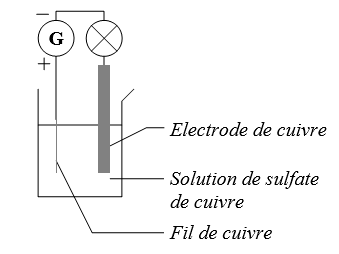
🖑 Réaliser le montage de la figure ci-contre.
🖑 Régler la tension du générateur pour que la lampe brille.
🖑 Laisser la manipulation se poursuivre.
b - Interprétation
1) Expliquer pourquoi, au bout d’un certain temps, la lampe s’éteint.
2) Proposer une interprétation en termes de réactions pour cette électrolyse.
3 - Électrolyse de l’eau (manipulation faite par le professeur)
a - Électrolyse
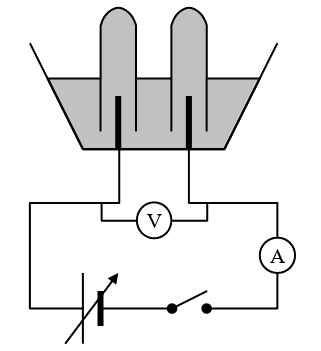
🖑 Le professeur réalise le montage de la figure ci-contre.
1) Qu’observe-t-on au niveau des électrodes ?
2) Dans quelles proportions les gaz se forment-ils ?
b - Tests des gaz formés
🖑 Le professeur réalise les tests pour identifier les gaz formés dans chaque tube.
3) Relever la borne du générateur correspondant à la formation de chaque gaz
c - Exploitation
4) Repérer le sens de circulation des électrons dans les conducteurs.
5) Écrire l'équation de la demi-réaction qui se produit au niveau de l’électrode reliée à la borne + du générateur
6) Écrire l'équation de la demi-réaction qui se produit au niveau de l’électrode reliée à la borne – du générateur.
7) En déduire l’équation de l’électrolyse.
8) Les volumes de gaz formés sont-ils en accord avec l’équation de la réaction d’hydrolyse ?
