15.A2 : Capacité électrique d'une pile
Compétences travaillées :
• Déterminer la capacité électrique d’une pile à partir de sa constitution initiale.
I - Définitions
1) Capacité électrique d’une pile

Définition
La capacité électrique d’une pile est la charge électrique maximale que la pile est susceptible de faire circuler dans le circuit extérieur. Elle se note \(Q\) et s'exprime en coulomb (\(\pu{C}\)).
Les unités
Le \(\pu{C}\) (coulomb) est équivalent à des \(\pu{A·s}\) (ampère × seconde).
Certaines piles rechargeables font mention de leur capacité électrique en l’exprimant en \(\pu{mAh}\) (milliampère·heure).
2) Constante de Faraday
La constante de Faraday, notée \(F\), est une grandeur physique qui correspond à la valeur absolue de la charge molaire de l’électron. \(F = \pu{9,65E4 C·mol–1}\).
Autrement dit, \(\pu{1 mol}\) d’électron à une charge de \(\pu{9,65E4 C}\).
II - Calcul de la capacité électrique d’une pile
La capacité électrique d’une pile se calcule à partir de la connaissance de la réaction qui se produit et des quantités de matières initiales de réactifs.
• On ajoute une colonne au tableau d’avancement afin de déterminer la quantité de matière d’électrons échangés dans l’état final \(n_f (e^–)\).
• On en déduit la charge électrique \(Q\) échangée en utilisant la constante de Faraday : \(Q = n_f (e^–)·F\)
III - Exemples
1) Pile Daniell Cuivre/Zinc
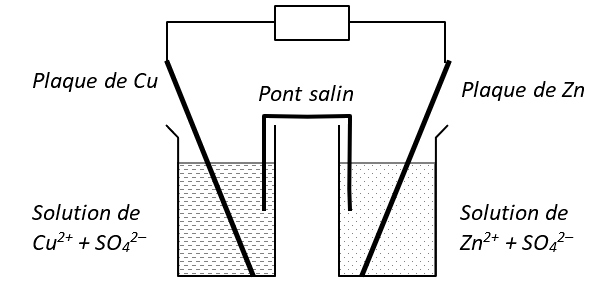
Les demi-piles sont constituées d'un volume \(V = \pu{150 mL}\) de solution de concentration \(c = \pu{1,0E-2 mol*L-1}\) et d'une électrode métallique.
On admettra que la réaction spontanée se fait entre les ions cuire \(\ce{Cu^2+(aq)}\) et le zinc \(\ce{Zn(s)}\) et que cette réaction peut être considérée comme totale.
Par ailleurs, l'électrode de zinc est suffisamment massive pour que le zinc soit en excès.
Question : Calculer la capacité électrique \(Q\) de la pile.
2) Pile Daniell Cuivre/Aluminium
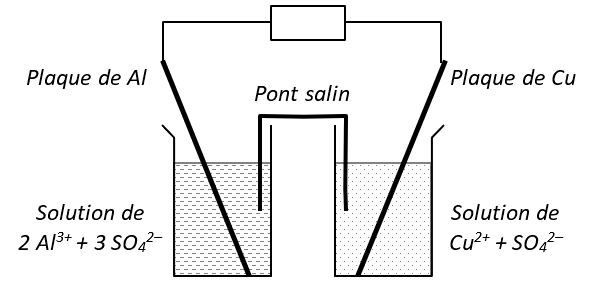
Les demi-piles sont constituées d'un volume \(V = \pu{200 mL}\) de solution de concentration \(c = \pu{5,0E-1 mol*L-1}\) et d'une électrode métallique.
On admettra que la réaction spontanée se fait entre les ions cuire \(\ce{Cu^2+(aq)}\) et l'aluminium \(\ce{Al(s)}\) et que cette réaction peut être considérée comme totale.
Par ailleurs, l'électrode de zinc est suffisamment massive pour que le zinc soit en excès.
Question : Calculer la capacité électrique \(Q\) de la pile.
