13.E10 : Le violet de gentiane
Le violet de gentiane, naturellement présent dans certaines plantes, peut être synthétisé en laboratoire à partir de diméthylaniline et de tétrachlorométhane. Voici une partie du protocole à suivre : sous hotte aspirante, introduire dans un erlenmeyer \(\pu{10 ml}\) de diméthylaniline et \(\pu{10 ml}\) de tétrachlorométhane. Agiter durant \(\pu{5 min}\). Filtrer le contenu de l’erlenmeyer pour récupérer le produit obtenu.
Données :
| Espèce chimique | Formule | Masse molaire | TFusion | TÉbullition | Densité | Sécurité |
|---|---|---|---|---|---|---|
| Diméthylaniline | \(\ce{C8H11N}\) | \(\pu{121,2 g*mol-1}\) | \(\pu{2 °C}\) | \(\pu{194 °C}\) | \(\pu{0,956}\) |   |
| Tétrachlorométhane | \(\ce{CCl4}\) | \(\pu{153,8 g*mol-1}\) | \(\pu{-23 °C}\) | \(\pu{77 °C}\) | \(\pu{1,594}\) |   |
| Violet de gentiane | \(\ce{C25H30N3Cl}\) | \(\pu{408,0 g*mol-1}\) | \(\pu{215}\) |   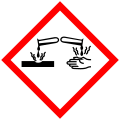 |
||
| Chlorure d’hydrogène | \(\ce{HCl}\) | \(\pu{36,5 g*mol-1}\) | \(\pu{-114 °C}\) | \(\pu{-85 °C}\) |    |
1 Sachant qu’au cours de la réaction il se forme également du chlorure d’hydrogène, écrire l’équation de la réaction.
2 Indiquer l'état de chaque espèce chimique à \(\pu{20 °C}\).
3 Expliquer pourquoi cette synthèse doit se faire sous la hotte.
4 Calculer la masse des deux réactifs introduits. Lequel est en défaut.
5 Indiquer le procédé qui permet de récupérer le produit désiré du reste du mélange réactionnel.
