10.E11 : Diagramme de prédominance d’un acide α-aminé
L’alanine est un acide α-aminé très fréquent dans les protéines.
À \(pH = \pu{7}\), elle existe sous la forme d’un zwitterion dont la formule semi-développée est donnée ci-dessous.
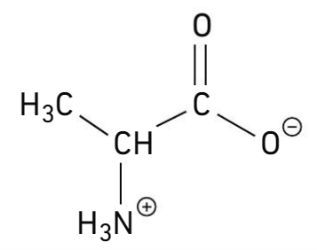
1 Qu’est qu’un acide α-aminé ?
2 Quel est l’acide conjugué du zwitterion ? Quelle est sa base conjuguée ?
3 En déduire les couples auxquels appartient le zwitterion. Comment appelle-t-on une telle espèce ?
4 Les \(pK_A\) de ces couples valent \(\pu{2,3}\) et \(\pu{9,7}\). Sachant que les acides carboxyliques \(\ce{R–COOH}\) sont des acides plus forts que les ions carboxylammonium \(\ce{R–NH3+}\), attribuer à chaque couple une valeur de \(pK_A\). Justifier.
5 Représenter le diagramme de prédominance de ces couples.
6 Le zwitterion est-il bien l’espèce prédominante à \(pH = \pu{7}\) ?
