Chap10 : Équilibre acide-base
I - Produit ionique de l’eau
1 - Définition
• Réaction d’autoprotolyse de l’eau : \(\ce{2 H2O ⇄ HO– + H3O+}\).
• La constante d’équilibre de cette réaction est appelée produit ionique de l’eau. Elle est notée \(K_e\).
• On obtient \(K_e = \left(\dfrac{[\ce{H3O+}]_{Éq}}{c^0}\right)\left(\dfrac{[\ce{HO–}]_{Éq}}{c^0}\right)\). Soit, en \(\pu{mol*L-1}\) : \(K_e = [\ce{H3O+}]_{Éq}×[\ce{HO–}]_{Éq}\)
• On définit également \(pK_e\) : \(pK_e = –log(Ke)\) ou \(K_e = 10^{-pKe}\)
• A \(\pu{25 °C}\), \(K_e = \pu{1,0E–14}\) et \(pKe = 14\).
2 - Utilisation
Le produit ionique de l'eau permet de calcul \([\ce{HO-}]\) à partir de \([\ce{H3O+}]\) et inversement.
II - Constante d’acidité d’un couple acide-base
1 - Définition
La constante d’acidité, notée \(K_A\), d’un couple acide-base est la constante d’équilibre de la réaction de l’acide avec l’eau.
La réaction de l'acide AH avec l'eau étant : \(\ce{AH + H2O ⇄ A– + H3O+}\)
On obtient \(K_A = \dfrac{\left(\dfrac{[\ce{H3O+}]_f}{c^0}\right)\left(\dfrac{[\ce{A–}]_f}{c^0}\right)}{\left(\dfrac{[\ce{AH}]_f}{c^0}\right)}\). Et donc, en \(\pu{mol*L-1}\) \(K_A = \dfrac{[\ce{H3O+}]_f×[\ce{A–}]_f}{[\ce{AH}]_f}\)
2 - pKA
• On définit le \(pK_A\) par : \(pK_A = –log(K_A)\) ou \(K_A = 10^{–pKA}\).
• On montre que \(pK_A = pH - log\left(\dfrac{[A^–]_f}{[AH]_f}\right)\). Soit aussi \(pH = pK_A + log\left(\dfrac{[A^–]_f}{[AH]_f}\right)\)
3 - Détermination de la constante d'acidité à partir d'une mesure de pH
III - Fort ou faible
1 - Définition
Un acide fort est un acide qui réagit totalement avec l’eau : AH + H2O → A– + H3O+.
Un acide faible est un acide dont la réaction avec l’eau est limitée : AH + H2O ⇄ A– + H3O+.
Une base forte est une base qui réagit totalement avec l’eau : B + H2O → BH+ + HO–.
Une base faible est une base dont la réaction avec l’eau est limitée : B + H2O ⇄ BH+ + HO–.
2 - Remarque
Lorsque l'acide est fort, la base conjuguée est inerte (elle ne réagit pas avec l'eau).
Lorsque l'acide est faible, la base conjuguée est également faible.
Lorsque la base est forte, l'acide conjugué est inerte (il ne réagit pas avec l'eau).
IV - Acide fort et base forte
1 - pH d’une solution formée à partir d’un acide fort
Considérons une solution d’acide fort de concentration \(C_A\).
Chaque molécule d’acide libère un proton qui est capté par l’eau pour donner un ion oxonium.
La concentration en ion oxonium dans l'état final est donc égale à la concentration en acide apporté : \([\ce{H3O+}]_f = C_A\).
Donc, pour une solution d'acide de concentration \(C_A\) : \(pH = –log(C_A)\).
Remarque : Si \([\ce{H3O+}]_f < C_A\) c’est que l’acide est faible.
2 - pH d’une solution formée à partir d’une base forte
Considérons une solution de base forte de concentration \(C_B\).
Chaque molécule de base capte un proton en provenance d’une molécule d’eau pour donner un ion hydroxyde.
La concentration en ion hydroxyde est donc égale à la concentration en base : \([\ce{HO–}]_f = C_B\).
Donc, pour une solution de base de concentration \(C_B\) : \(pH = –log\left(\dfrac{Ke}{C_B}\right)\).
Remarque : si \([\ce{HO–}]_f < C_B\), c'est que la base est faible.
V - Acides faibles et bases faibles
1 - pH d’une solution d’acide faible ou de base faible
10.A2 - Composition d'une solution d'acide faible (avec du Python)
2 - Taux d'avancement final d'une solution d'acide faible ou de base faible
10.A1 - Acide fort, acide faible
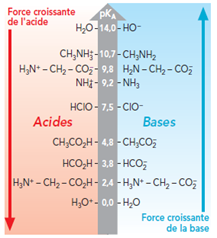
3 - Forces des acides et des bases : échelle des pKa
Les couples acide faible / base faible ont un \(pK_A\) compris entre \(0\) et \(14\).
Pour un acide :
- plus le \(pK_A\) est petit,
- plus l’acide est fort,
- plus la réaction de l’acide avec l’eau se fait facilement.
Pour une base :
- plus le \(pK_A\) est grand,
- plus la base est forte,
- plus la réaction de la base avec l’eau se fait facilement.
4 - Diagramme de prédominance
a - Raisonnement préliminaire
On a vu que : \(pH = pK_A + log\left(\dfrac{[\ce{A–}]}{[\ce{AH}]}\right)\)
Donc :
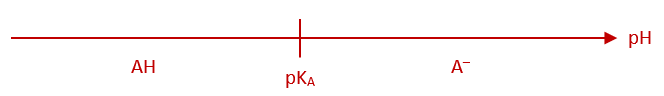
- - si \(pH > pK_A\), alors \(log\left(\dfrac{[\ce{A–}]}{[\ce{AH}]}\right) > 0\), alors \([\ce{A–}] > [\ce{HA}]\), alors c'est la base qui prédomine.
- - si \(pH < pK_A\), alors \(log\left(\dfrac{[\ce{A^–}]}{[\ce{AH}]}\right) < 0\), alors \([\ce{A–}] < [\ce{HA}]\), alors c'est l'acide qui prédomine.
b - Diagramme de prédominance
Le diagramme de prédominance est un axe de pH sur lequel on indique les domaines pour lesquels l'une ou l'autre forme est prédominante.
Ainsi, pour le couple \(\ce{AH/A–}\), le diagramme de prédominance est :
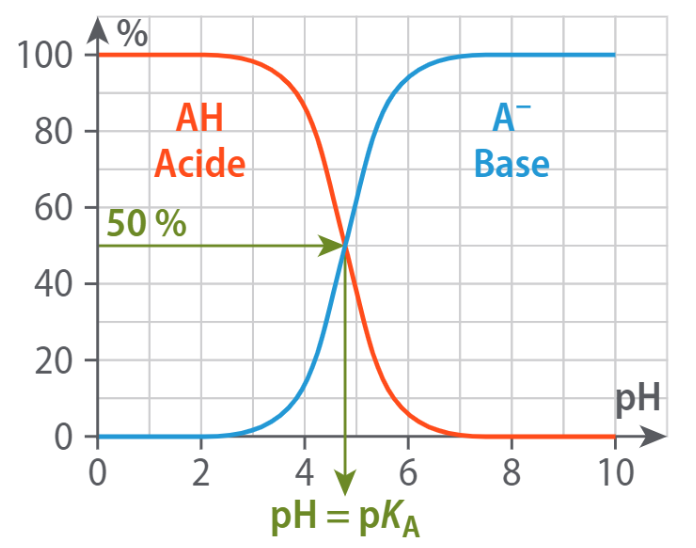
5 - Diagramme de distribution
Le diagramme de distribution est un graphique qui donne les proportions (en général en %) d'acide et de base d'un couple en fonction du pH.
6 - Cas des indicateurs colorés
a - Définition
Les indicateurs colorés sont des couples acide / base pour lesquels l’acide et la base ont des couleurs différentes.
b - Exemples
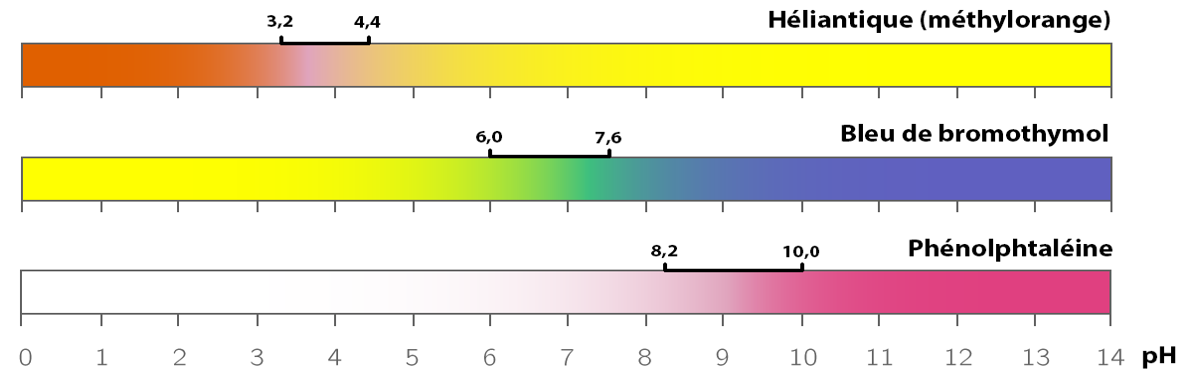
Les indicateurs colorés sont entre autres utilisés pour les dosages par suivi pH-métrique.
7 - Cas des acides alpha-aminés
VI - Solution tampon
1 - Définition
Une solution tampon est une solution dont le pH varie très peu :
- - lorsqu’on ajoute une petite quantité d’acide ou de base,
- - lorsque l’on dilue un peu la solution.
Remarque : Dans une solution tampon simple il y a un acide faible et sa base conjuguée en même quantité. Le \(pH\) est alors égal au \(pK_A\) du couple.
2 - Utilisation des milieux tamponnés
a - Rôle des solutions tamponnées en milieu biologique
Information : Les transformations biochimiques qui se déroulent dans les organismes vivants ne se font de façon optimale que pour un domaine de pH bien précis. Il est donc nécessaire que le pH des liquides biologiques varie très peu : les liquides biologiques sont pour la plupart des milieux tamponnés. Il en est ainsi de la salive, du suc gastrique ou du suc intestinal…
b - En laboratoire
Information : Les solutions tamponnées sont très utilisées en laboratoire :
- - solution d’étalonnage des pH-mètres,
- - solution de cultures en biochimie…
