7.E2 : Étude cinétique par suivi spectrophotométrique
On se propose d’étudier la cinétique de la transformation lente de décomposition de l’eau oxygénée par les ions iodure en présence d’acide sulfurique, transformation considérée comme totale.
L’équation de la réaction qui modélise la transformation d’oxydoréduction s’écrit :
\(\ce{H2O2 (aq) + 2 I–(aq) + 2 H+(aq) -> 2 H2O(l) + I2 (aq) (1)}\)
La solution de diiode formée étant colorée, la transformation est suivie par spectrophotométrie, méthode qui consiste à mesurer l'absorbance A de la solution, grandeur proportionnelle à la concentration en diiode.
À la date \(t = \pu{0 s}\), on mélange \(\pu{20,0 mL}\) d'une solution d'iodure de potassium de concentration \(\pu{0,10 mol·L-1}\) acidifiée avec de l'acide sulfurique en excès et \(\pu{2,0 mL}\) d'eau oxygénée à \(\pu{0,10 mol·L-1}\). On remplit une cuve spectrophotométrique, et on relève les valeurs de l'absorbance au cours du temps. On détermine alors la concentration \(\ce{[I_2]}\) du diiode formé. L'expérience est faite dans un bain d'eau glacée. On obtient la courbe suivante :
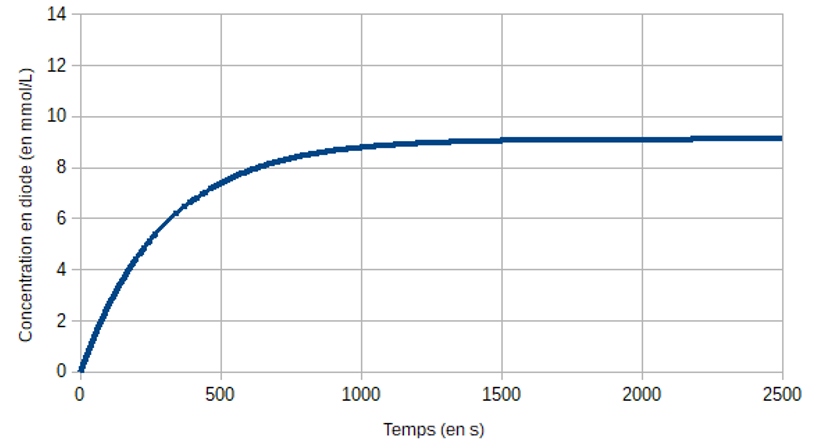
1 Quelle démarche a permis de déterminer les concentrations en diode formé à partir des mesures d'absorbance (aucun calcul n'est demandé).
2 Pour cette question on pourra s'aider d'un tableau d'avancement.
Quel est le réactif limitant ? Déterminer la valeur théorique de la concentration en diiode formé lorsque la transformation est terminée. La valeur trouvée est-elle en accord avec la courbe.
3 Donner la définition du temps de demi-réaction \(t_½\), puis le déterminer, en faisant apparaître la méthode sur le graphique.
4 On réalise à température ambiante la même réaction que précédemment, avec les mêmes quantités de réactifs. Représenter sur le graphique l'allure de la courbe que l'on devrait obtenir.
5 Quel autre facteur cinétique peut-on modifier pour augmenter la vitesse de la réaction ?