Chap07 : Évolution temporelle d'une transformation chimique
I - Suivi temporel (ou suivi cinétique)
1 - Exemples de réactions lentes et rapides
• Les explosions sont des réactions rapides.
• La dégradation de certaines denrées alimentaires (comme le fait qu'une huile ou du beurre devienne rance) est une réaction lente (qui dépend des conditions, les denrées alimentaires se conservent plus longtemps au frais).
• La formation de la rouille est une réaction très lente (qui dépend des conditions extérieures, la rouille se forme plus facilement en milieu salin).
2 - Comment suivre l’évolution d’une réaction ?
Spectrophotomètre : La réaction doit consommer ou produire des espèces chimiques colorées
Conductimètre : La réaction doit consommer ou produire des espèces chimiques chargées électriquement
Pressiomètre : La réaction doit consommer ou produire des espèces à l’état gazeux
3 - Évolution des quantités de matières au cours du temps
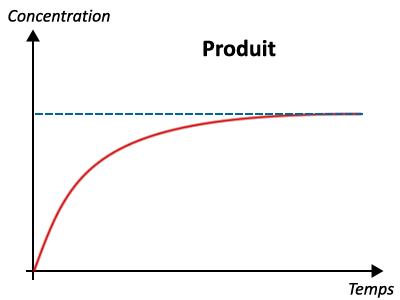
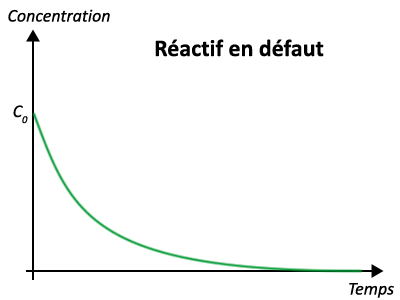
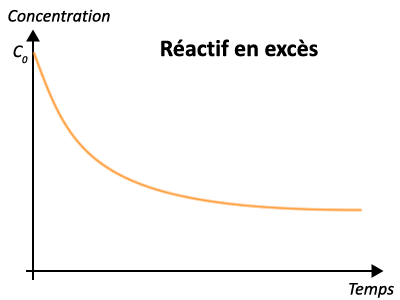
II - Exploitation des courbes
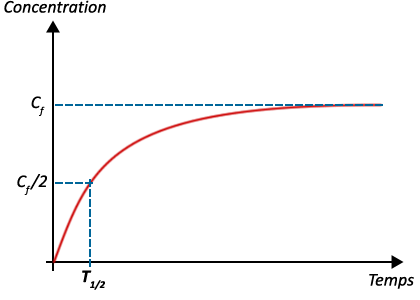
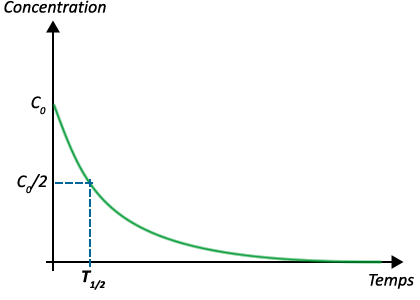
1 - Temps de demi-réaction
Le temps de demi-réaction est noté \(t_½\) et s’exprime en \(\pu{s}\).
C’est le temps au bout duquel :
- - les quantités ou les concentrations de chaque produit ont atteint la moitié de leur valeur finale.
- - la moitié du réactif limitant a été consommée,
Le temps de demi-réaction se détermine sur les courbes.
2 - Vitesse volumique d’évolution
a - Vitesse volumique d’apparition
La vitesse d’apparition d'un produit \(P\) est : \(v_{app} = \dfrac{d[P]}{dt}\)
Conséquences :
- ▶ \(v_{app}\) est le coefficient directeur de la tangente à la courbe ;
- ▶ à partir des données expérimentales : \(v_{app~i} = \dfrac{[P]_{i+1}-[P]_i}{t_{i+1}-t_i}\) où \(i\) est la \(i^{ème}\) donnée.
b - Vitesse volumique de disparition
La vitesse de disparition d'un réactif \(R\) est : \(v_{disp} = -\dfrac{d[R]}{dt}\).
Conséquences :
- ▶ \(v_{disp}\) est l’opposé du coefficient directeur de la tangente à la courbe (valeur positive) ;
- ▶ à partir de données expérimentales, \(v_{disp~i} = -\dfrac{[R]_{i+1}-[R]_i}{t_{i+1}-t_i}\) où \(i\) est la \(i^{ème}\) donnée.
3 - Modélisation de l’évolution temporelle : loi de vitesse d’ordre 1
a - Définition
Une réaction est d’ordre 1 par rapport à l’un de ses réactifs \(R\) si la vitesse de disparition de ce réactif est à chaque instant proportionnelle à sa concentration : \(v_{disp~de~R} = k×[R]\)
b - Reconnaitre une loi de vitesse d’ordre 1
Méthode 1 :
- A partir des données de \([R](t)\), calculer les valeurs de \(v_{disp}(t)\) et tracer \(v_{disp}\) en fonction de \([R]\).
- Si cette courbe est une droite qui passe par l’origine, alors la vitesse suit une loi d’ordre 1.
Méthode 2 :
- S’il est possible de modéliser la courbe \([R](t)\) par une fonction exponentielle, alors la vitesse suit une loi d’ordre 1.
Méthode 3 :
- Tracer la courbe donnant \(ln{\left(\frac{[R]}{[R]_0}\right)}\) en fonction du temps. Si la courbe obtenue peut être modélisée par une droite passant par l'origine, alors la vitesse suit une loi d'ordre 1.
III - Comment modifier la vitesse d’une réaction
1 - Facteurs cinétiques
a - Définition
Un facteur cinétique est un paramètre qui modifie la vitesse réaction.
b - Exemples de facteurs cinétiques
▶ Influence de la concentration des réactifs : En général, plus les réactifs sont concentrés, plus la réaction est rapide.
▶ Influence de la température du milieu : En général, plus la température du milieu réactionnel est élevée, plus la réaction est rapide.
2 - Catalyse
Un catalyseur est une substance qui accélère une réaction possible, sans être altéré à la fin de la réaction (il est donc éventuellement consommé puis régénéré). Il n’intervient donc pas dans l’équation-bilan de la réaction.