Chap02 : Transformations acide-base
I - Les acides et les bases
1 - Définition de Bronsted d’un acide et d’une base
a - Définition
Selon la définition de Bronsted :
- - un acide est une espèce chimique susceptible de perdre un ou plusieurs ion hydrogène \(\ce{H+}\).
- - une base est une espèce chimique susceptible de capter un ou plusieurs \(\ce{H+}\).
b - Exemples
2.A1 - Transformation acide-base
• Exemples d'acides :
- - Un acide carboxylique \(\ce{R–COOH}\) peut perdre un \(\ce{H+}\) pour donner l'ion carboxylate \(\ce{R–COO-}\)
- - L'ion ammonium \(\ce{NH4+}\) peut perdre un \(\ce{H+}\) pour donner l'ammoniac \(\ce{NH3}\)
• Exemples de bases :
- - Un ion carboxylate \(\ce{R–COO-}\) peut gagner un \(\ce{H+}\) pour donner l'acide carboxylique \(\ce{R–COOH}\)
- - Une amine \(\ce{R-NH2}\) peut gagner un \(\ce{H+}\) pour donner \(\ce{R-NH3+}\)
c - Remarque
- Un acide est de la forme \(\ce{AH}\) ou \(\ce{AH+}\),
- Une base est de la forme \(\ce{B–}\) ou \(\ce{B}\).
- L’ion hydrogène \(\ce{H+}\) est très réactif en milieu aqueuse (voir la suite).
2 - Couple acide base
a - Présentation
A chaque acide est associé une base et inversement. L’acide et la base sont conjugués.
L’ensemble forme un couple acide/base auquel est associé une demi-réaction.
b - Exemples
2.A1 - Transformation acide-base
• \(\ce{R–COOH} / \ce{R–COO–}\) a pour demi-équation : \(\ce{R–COOH <=> R–COO– + H+}\)
• \(\ce{R–NH3+} / \ce{R–NH2}\) a pour demi-équation : \(\ce{R–NH3+ <=> R–NH2 + H+}\)
• En particulier \(\ce{NH4+} / \ce{NH3}\) a pour demi-équation : \(\ce{NH4+ <=> NH3 + H+}\)
c - Les couples de l’eau
L’eau est l’acide d’un couple et la base d’un autre couple : \(\ce{H3O+} / \ce{H2O}\) et \(\ce{H2O} / \ce{HO–}\).
3 - Identifier un acide ou une base
a - Schéma de Lewis de quelques acides et bases
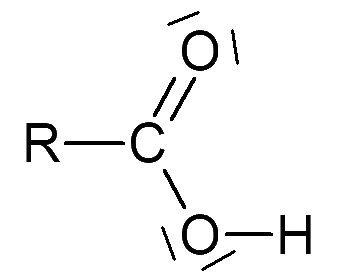
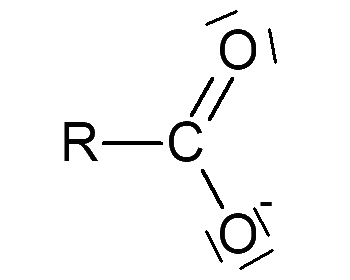

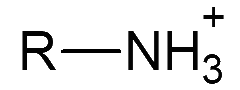
b - Interprétation du schéma de Lewis
Lorsque la liaison entre un H et la molécule est fortement polarisée –<–H, l’espèce peut être un acide. Lorsqu’un atome présente une charge partielle négative et/ou des doublets non liants, l’espèce peut être une base.
c - Exemples
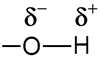
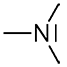
4 - Cas particulier des espèces amphotères
a - Définition
Un ampholyte (on dit aussi une espèce amphotère) est une espèce chimique qui peut se comporter à la fois comme un acide et comme une base.
b - Exemples
• L’eau
• Les acides α-aminé :
Formule générale d'un acide α-aminé
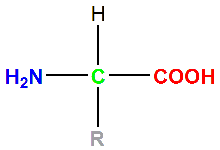
Remarque : à l'état pur, les acides α-aminés existent plutôt sous la forme \(\ce{H3N+–CHR–COO–}\).
Un acide α-aminé est un ampholyte, à la fois acide d'un couple et base d'un autre couples :
\(\ce{H3N+–CHR–COOH} / \ce{H3N+–CHR–COO–}\)
\(\ce{H3N+–CHR–COO–} / \ce{H2N–CHR–COO–}\).
• Les polyacides
Les polyacide donnes des ampholytes.
Exemple : l'espèce \(\ce{HSO4-}\) est un ampholyte :
\(\ce{H2SO4} / \ce{HSO4–}\)
\(\ce{HSO4–} / \ce{SO4^2–}\)
II - Réaction acido-basique
Manipulation au bureau : mélanger du carbonate de sodium avec du vinaigre.
1 - Equation générale
Lors d’une réaction acidobasique, l’acide d’un couple réagit avec la base d’un autre couple. Plus précisément : l'acide d'un couple cède un \(\ce{H+}\) qui est capté par la base d'un autre couple.
\(\ce{Acide couple 1 + Base couple 2 ⇌ Base couple 1 + Acide couple 2}\)
2 - Exemples
2.A1 - Transformation acide-base
3 - Lien entre les acides, les bases et le pH
a - Réactions d'un acide ou d'une base avec l’eau
• Réaction d’un acide avec l'eau :
- \(\ce{AH + H2O <=> A- + H3O+}\)
- \(\ce{AH+ + H2O <=> A + H3O+}\)
• Réaction d’une base avec l’eau
- \(\ce{B + H2O <=> BH+ + HO-}\)
- \(\ce{B– + H2O <=> BH + HO-}\)
b - Lien entre les acides, les bases et le pH
Lorsqu’un acide est ajouté à un milieu aqueux, il y a formation d’ion \(\ce{H3O+}\), ce qui acidifie le milieu, il y a diminution du pH.
Lorsqu’une base est ajoutée à un milieu aqueux, il y a consommation d’ion \(\ce{H3O+}\), ce qui rend le milieu moins acide (donc plus basique), il y a augmentation du pH.