Chap01 : Analyse physique d'un système chimique
I - Quelques notions pour prendre un bon départ
1) Les solutions aqueuses (rappels)
• Concentrations en masse et en quantité de matière
• Préparation d’une solution par dissolution et par dilution
1.A1 - Rappels sur les solutions
2) Les molécules en chimie organique
a) Quelques familles de molécules
1.A2 - Les molécules en chimie organique
b) Représentations d'une molécule
Formule brute : elle donne le symbole et le nombre des éléments chimiques qui compose la molécule.
Formule semi-développée : elle donne le détail des liaisons entre les atomes d'une molécule, sans détailler les liaisons vers les atomes d'hydrogène.
Formule développée : elle donne le détail de toutes les liaisons entres les atomes d'une molécule.
Formule topologique : elle donne le détail des liaisons entre les atomes d'une molécule, sans représenter les atomes de carbone et d'hydrogènes liés à des carbones.
c) Nomenclature
II - Mesures d’absorbance dans l’UV-visible
1) Absorbance
L’absorbance mesure l’aptitude d’une solution à absorber le rayonnement qu’elle reçoit à une longueur d’onde donnée. Elle se note \(A\) et s’exprime sans unité.
Communément, l'absorbance a des valeurs entre 0 et 3 ou 4.
L'absorbance se mesure avec un colorimètre ou un spectrophotomètre.
2) Loi de Beer-Lambert
a) Énoncé de la loi de Beer-Lambert
L’absorbance d'une espèce chimique en solution est proportionnelle à la concentration de cette espèce chimique :
- - pour une espèce chimique : \(A = k·[\text{espèce chimique}]\)
- - pour une solution : \(A = k·C\)
b) Remarques
Le coefficient de proportionnalité \(k\) est le même pour toutes les longueurs d’onde.
Lorsqu’il y a plusieurs espèces chimiques dans une solution, les absorbances s’additionnent.
c) Limites de validité de la loi de Beer-Lambert
La proportionnalité n’est valable que pour les espèces chimiques peu concentrées.
3) Analyse spectrale dans l’UV-visible
1.A3 - Spectroscopie UV-visible
a) Spectre
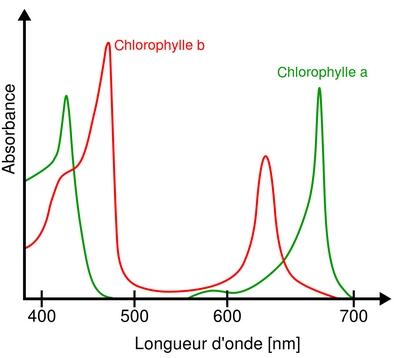
Le spectre d'absorbance d'une espèce chimique en solution est construit de la façon suivante :
- - axe des abscisses : la longueur d'onde \(λ\)
- - axe des ordonnées : l’absorbance \(A\)
b) Propriété
L’allure du spectre est spécifique d’une espèce chimique. L’identification d'une espèce chimique peut se faire par comparaison de son spectre avec des spectres d'espèces chimiques connues.
4) Dosage par étalonnage
III - Mesures de transmittance dans l’IR
1) Spectre IR
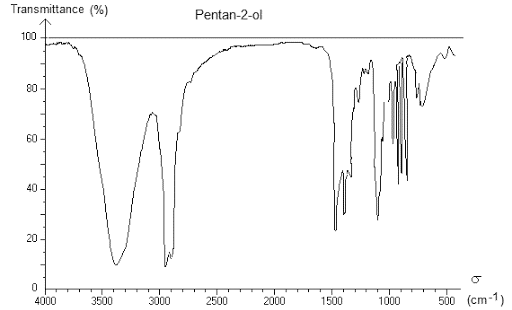
Le spectre IR d'une espèce chimique est constitué de la façon suivante :
- - axe des abscisses : le nombre d’onde \(\sigma\) en \(\pu{m–1}\). Par définition \(\sigma = \dfrac{1}{\lambda}\)
- - axe des ordonnées : la transmittance \(T\), en \(\%\). C’est le pourcentage de lumière qui traverse la solution pour chaque longueur d’onde.
2) Analyse du spectre
Propriété
L'analyse d'un spectre IR permet d'identifier les groupes caractéristiques d'une molécule.
IV - Mesures de conductivité
1) Conductance et conductivité
1.TP1 - Qu'est-ce que la conductivité ?
a) Conductance
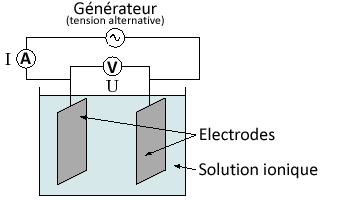
Définition : La conductivité rend compte de l’aptitude d’une portion de solution à laisser passer le courant.
Elle se note \(G\) et s’exprime en siemens (\(\pu{S}\)).
Formule : \(G = \dfrac{I}{U}\)
Remarque : la conductance dépend de la géométrie de la portion de solution étudiée.
b) Conductivité
Afin de s’affranchir de la géométrie de la portion de solution étudiée, le chimiste préfère travailler avec la conductivité.
Définition : la conductance rend compte de l’aptitude d’une solution à laisser passer le courant. Elle se note \(\sigma\) et s’exprime en \(\pu{S*m-1}\).
2) Loi de Kohlraush
a) Énoncé pour une solution
La conductivité d'une solution est proportionnelle à la concentration de la solution : \(\sigma = k·C\)
b) Énoncé pour des ions en solution
• Pour un ion en solution : \(\sigma_{ion} = λ_{ion}·[ion]\)
où \(λ_{ion}\) est la conductivité molaire ionique de l'ion \(ion\) en \(\pu{S*m2*mol-1}\)
• Lorsqu’il y a plusieurs ions en solution : \(\sigma_{solution} = \sigma_{ion\ 1} + \sigma_{ion\ 2}\ + ...\)
Attention : dans ces formules les concentrations sont en \(\pu{mol*m-3}\).
c) Limites de validité de la loi
La proportionnalité n’est valable que pour les solutions et les ions peu concentrés.
3) Dosage par étalonnage
V - Le pH : caractère acide ou basique d’une solution
Le pH d’une solution est lié à la concentration en ion oxonium \(\ce{H3O+}\).
\(pH = -log(\dfrac{[\ce{H3O+}]}{c°})\) et \([\ce{H3O+]} = c°×10^{-pH}\)
\(c°\) est la concentration standard. \(c° = \pu{1 mol*L–1}\).
Le pH est une grandeur sans unité.